
Až 95 % plicních uzlů je benigní etiologie. Solitární plicní uzel (SPN) však může být i metastázou nebo primárním bronchogenním karcinomem v časném stadiu.
Benigní uzly mohou být infekční etiologie, například mykobakteriózy včetně tuberkulózy, histoplazmóza, echinokoková cysta nebo kokcidióza.
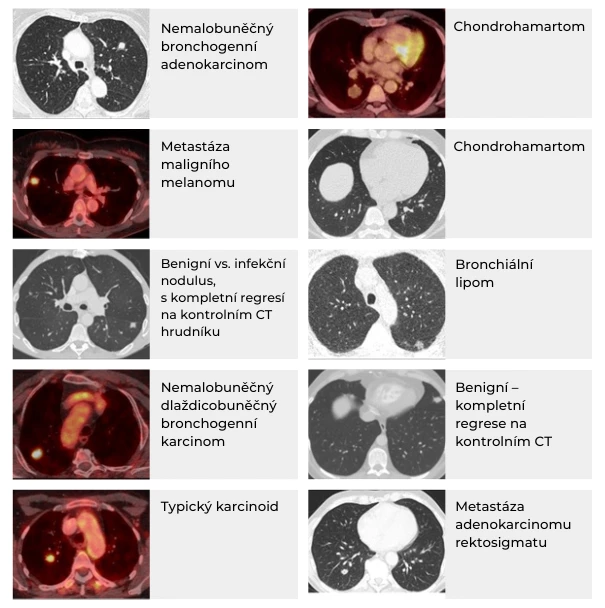
Mezi neinfekční etiologie SPN patří například uzly u revmatoidní artritidy, granulomatózy s polyangiitidou, bronchogenní cysty, arteriovenózní malformace, okrouhlá atalektáza, plicní infarkt nebo intrapulmonální lymfatické uzliny. Také některé benigní plicní nádory se mohou prezentovat jako plicní uzly, patří mezi ně hamartomy/chondrohamartomy, fibromy, lipomy, hemangiomy, teratomy či leiomyomy. SPN však může imitovat i prosté uvíznutí hlenu v bronších.1, 2
Mezi maligní příčiny plicního uzlu řadíme například primární bronchogenní karcinom, karcinoid, lymfom, sarkom a metastatický proces.
Hlavním prediktorem malignity je velikost plicního uzlu, a pokud máme k dispozici CT ke srovnání, potom i dynamika růstu.
K určení velikosti uzlu se používá manuálně měřený průměr krátké a dlouhé osy, přesnější možností je poloautomatické měření objemu.3 S velikostí uzlu se zvyšuje i pravděpodobnost malignity. Prevalence malignity u uzlů o velikosti < 5 mm (80 mm3) je minimální (≤ 1 %), při velikosti 5–10 mm již stoupá na 6–28 %, u uzlů v rozmezí 11–20 mm je prevalence malignity 33–64 %, a u uzlů o velikosti > 20 mm dokonce 64–82 %.4, 5
Dynamika růstu uzlu se stanoví buď porovnáním rozměru/objemu uzlu na jednotlivých snímcích CT, nebo se určuje tzv. volume doubling time (VDT) neboli doba, za kterou uzel zdvojnásobí svůj objem (u většiny maligních uzlů je to 30–400 dní).6
Obr. Příklady etiologie plicních uzlů
MUDr. Lenka Návratová
1. klinika tuberkulózy a respiračních nemocí 1. LF UK a VFN v Praze
Reference:
- 1. Choromańska A., Macura K. J. Evaluation of solitary pulmonary nodule detected during computed tomography examination. Pol J Radiol 2012; 77 (2): 22–34, doi: 10.12659/pjr.882967.
- 2. Callister M. E., Baldwin D. R., Akram A. R. et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules. Thorax 2015; 70 (Suppl. 2): ii1–ii54, doi: 10.1136/thoraxjnl-2015-207168.
- 3. Han D., Heuvelmans M. A., Oudkerk M. Volume versus diameter assessment of small pulmonary nodules in CT lung cancer screening. Transl Lung Cancer Res 2017; 6 (1): 52–61, doi: 10.21037/tlcr.2017.01.05.
- 4. Wahidi M. M., Govert J. A., Goudar R. K. et al. Evidence for the treatment of patients with pulmonary nodules: when is it lung cancer? ACCP evidence-based clinical practice guidelines (2nd ed.). Chest 2007; 132 (3 Suppl.): 94S–107S, doi: 10.1378/chest.07-1352.
- 5. Nasim F., Ost D. E. Management of the solitary pulmonary nodule. Curr Opin Pulm Med 2019; 25 (4): 344–353, doi: 10.1097/MCP.0000000000000586.
- 6. Li J., Xia T., Yang X. et al. Malignant solitary pulmonary nodules: assessment of mass growth rate and doubling time at follow-up CT. J Thorac Dis 2018; 10 (Suppl. 7): S797–S806, doi: 10.21037/jtd.2018.04.25.

